김영신 medicalkorea1@daum.net
2월 제약사 주요 이모저모는 다음과 같다.
◆뉴메코, ‘뉴럭스(NEWLUX)’의 컨센서스 논문 SCIE급 학술지 게재
메디톡스(대표 정현호) 계열사 뉴메코(대표 주희석)가 보툴리눔 톡신 제제 ‘뉴럭스’에 대한 국내 전문가들의 컨센서스 논문이 SCIE급 학술지인 ‘톡신즈(Toxins)’에 ‘안면 표정 근육에 대한 신규 보툴리눔 독소 A형 제품(NEWLUX)의 미용적 사용에 대한 합의: 2024년 한국 전문가들의 가이드라인 및 논의[Consensus on the Cosmetic Use of a Novel Botulinum Neurotoxin Type A Product (NEWLUX) for Facial Expression Muscles: 2024 Guidelines and Discussions by Korean Experts]’이다.
이번 논문은 ‘미국 피부외과학회지(Dermatologic Surgery)’에 2013년 게재된 국내 전문가들의 합의된 가이드라인 논문(Consensus recommendations on the aesthetic usage of botulinum toxin type A in Asians)내용을 포함하고 있으며, 지난 십여 년간의 톡신 제제 시술 트렌드를 반영했다.
뉴메코 주희석 대표는 “국내 전문가들이 모여 차세대 톡신 제제 ‘뉴럭스’로 컨센서스 연구를 진행하고, 가이드라인을 제시하는 연구 결과가 발표되어 매우 영광스럽다.”라며, “앞으로도 안전하고 효과적인 보툴리눔 톡신 치료법이 반영될 수 있도록 지원과 노력을 아끼지 않겠다.”라고 밝혔다.
◆셀트리온, 아일리아 바이오시밀러 ‘아이덴젤트’ 유럽 허가
셀트리온이 유럽연합집행위원회(EC, European Commission)로부터 아일리아(EYLEA) 바이오시밀러 아이덴젤트(EYDENZELT, 개발명: CT-P42)의 품목허가를 획득했다.
승인 제형은 아이덴젤트주사(Vial), 아이덴젤트 프리필드시린지(PFS) 등 두 종류이다.
아이덴젤트는 오리지널 의약품이 보유한 신생혈관성(습성) 연령관련 황반변성(wAMD), 망막정맥 폐쇄성 황반부종, 당뇨병성 황반부종(DME), 근시성 맥락막 신생혈관 등 주요 적응증에 대해 허가를 획득했다.
셀트리온 관계자는 “셀트리온은 이번 아이덴젤트의 품목허가를 통해 유럽 시장에서 제품 포트폴리오 영역을 확대하고 글로벌 시장 공략에 속도를 낼 수 있게 됐다.”라며, “앞서 다른 후속 제품들의 승인 권고를 통해 지속적인 허가 승인이 이뤄질 것으로 기대되는 만큼, 빠른 제품 출시와 시장 지배력 강화에 최선을 다하겠다.”라고 말했다.
◆삼성바이오에피스, 골질환 치료제 2종 미국·유럽 품목허가 획득
삼성바이오에피스(대표이사 김경아 사장)가 미국 식품의약국(FDA: Food and Drug Administration)과 유럽 집행위원회(EC: European Commission)로부터 골질환 치료제 프롤리아∙엑스지바(Prolia & Xgeva, 성분명 데노수맙)1) 바이오시밀러 제품 2종의 품목허가를 각각 획득했다.
프롤리아와 엑스지바는 글로벌 제약사 암젠(Amgen)이 개발한 바이오의약품으로, 용량과 투약 주기에 따라 골다공증 치료제(프롤리아)와 골거대세포종 등의 치료제(엑스지바)로 구분된다.
지난해 두 제품의 연간 합산 글로벌 매출액은 65억 9,900만 달러(약 9.7조원)이다.
삼성바이오에피스는 오리지널 의약품과 동일하게 적응증 별로 각각 품목 허가를 획득했다. 프롤리아 바이오시밀러는 미국에서 ‘오스포미브(Ospomyv™)’, 유럽에서 ‘오보덴스(Obodence™)’로, 엑스지바 바이오시밀러는 미국과 유럽 동일하게 ‘엑스브릭(Xbryk™)’의 제품명으로 승인받았다.
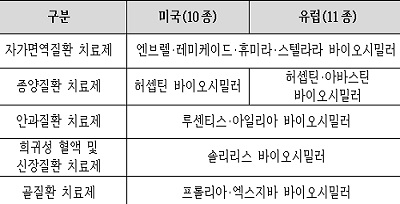
이로써 삼성바이오에피스는 미국에서 10종, 유럽에서 11종의 바이오시밀러 제품을 확보했다.
삼성바이오에피스 RA(Regulatory Affairs)팀장 정병인 상무는 “미국과 유럽에서 모두 프롤리아∙엑스지바 바이오시밀러의 승인을 받게 돼 기쁘며, 앞으로도 다양한 질환 분야에서의 바이오시밀러 개발을 통해 전 세계 환자들의 의약품 미충족 수요(unmet needs)를 해소할 수 있도록 지속 노력할 것이다.”라고 말했다.
◆한미약품, CCR4 타깃 면역항암 혁신신약 임상 2상서 ‘완전관해’ 확인
한미약품이 미국 랩트(RAPT Therapeutics) 및 MSD와 협업해 진행한 임상 2상 시험에서 CCR4 타깃 경구용 면역항암제 ‘티부메시르논(코드명: FLX475)’과 면역관문억제제 ‘키트루다(KEYTRUDA, 성분명: 펨브롤리주맙·pembrolizumab)’ 병용요법의 잠재력을 입증했다.
한미약품은 지난 1월 23일부터 25일까지 미국 샌프란시스코에서 개최된 ‘2025 ASCO GI Cancers Symposium’(미국임상종양학회 소화기암 심포지엄)에 참가해 위암 혁신신약으로 개발 중인 ‘티부메시르논’ 임상 2상 단계 1의 최종 결과를 포스터 발표로 공개했다.
임상 2상 책임 연구자인 서울대병원 혈액종양내과 오도연 교수는 “티부메시르논과 키트루다 병용요법이 EBV 양성 위암 환자에서 긍정적인 항종양 효과를 보인데다 높은 객관적 반응률과 지속적 반응 기간을 확인한 점은 고무적이다.”라며, “이번 임상 결과는 CCR4 수용체를 타깃으로 한 면역항암 치료의 잠재력을 입증한 중요한 진전이다.”라고 평가했다.
[메디컬월드뉴스 김영신, 조응태 기자]
- TAG



 반려동물, 염증성 장질환(IBD) 만성 설사·구토 지속시 주의 필요
반려동물, 염증성 장질환(IBD) 만성 설사·구토 지속시 주의 필요
 리프팅부터 미니거상술까지…주요 특징 및 주의점
리프팅부터 미니거상술까지…주요 특징 및 주의점
 [신경외과에 대한 모든 것]목디스크로 오인하기 쉬운 ‘후종인대 골화증’, 진단부터 치료까지
[신경외과에 대한 모든 것]목디스크로 오인하기 쉬운 ‘후종인대 골화증’, 진단부터 치료까지
 휴대용 보조배터리 화재사고 예방을 위한 안전 수칙
휴대용 보조배터리 화재사고 예방을 위한 안전 수칙
 [치과에 대한 모든 것]성인 치아교정, 세심한 치료 계획 수립이 중요한 이유
[치과에 대한 모든 것]성인 치아교정, 세심한 치료 계획 수립이 중요한 이유






