김영신 medicalkorea1@daum.net
한국릴리(대표: 존 비클, John Bickel)가 재발성·불응성 외투세포림프종 치료제 ‘제이퍼카정 100mg(성분명 퍼토브루티닙)’을 지난 26일 국내 출시했다고 밝혔다.
제이퍼카는 현재까지 최초이자 유일한 가역적 브루톤 티로신 키나제(BTK) 억제제로, 올해 8월 식품의약품안전처로부터 이전에 BTK 억제제를 포함한 두 가지 이상의 치료를 받은 적이 있는 재발성 또는 불응성 외투세포 림프종(MCL) 성인 환자에서 단독요법으로 허가 받았다.
현재까지 재발성·불응성 외투세포림프종 환자에서 기존 BTK 억제제로 치료 후 질환이 진행된 경우, 해당 환자 집단에 사용하도록 국내 승인된 약물은 없었다.
제이퍼카는 한 가지 이상의 BTK 억제제로 치료 후 재발성 또는 불응성 MCL 환자를 대상으로 효과를 보인 임상적 근거가 있는 최초이자 유일한 가역적 BTK 억제제이며, 전임상 연구에 포함된 대부분의 키나제 (98%)보다 BTK에 대해 300배 더 선택적으로 억제하는 특징이 있다.
제이퍼카 승인 기반이 된 연구는 다기관, 공개 라벨, 단일군 연구인BRUIN 1/2상 임상으로, 해당 임상에서는 이전에 한 가지 이상의 BTK 억제제로 치료를 받은 재발성·불응성 외투세포림프종 성인 환자를 대상으로 제이퍼카의 임상적 유효성 및 안전성을 평가했다.
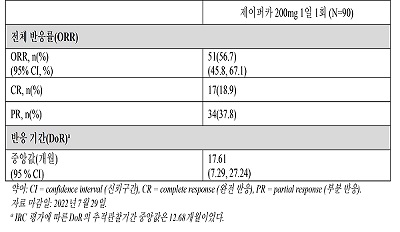
이전에 BTK 억제제를 1가지 이상 투여 받은 일차 분석군(primary analysis set, PAS) 90명을 살펴본 결과, 56.7%의 전체 반응률(ORR)과 17.6개월의 반응 기간(DoR)을 보였다.
[표] BRUIN 임상에서 이전에 한 가지 이상의 BTK 억제제를 투여 받은 MCL 환자의 유효성 결과
제이퍼카 투여 후 가장 흔하게 발생한 이상반응은 피로(26.3%), 중성구 감소증(22.8%), 설사(22.1%), 그리고 타박상(19.0%)이었다. 이상반응으로 인한 치료 중단의 빈도는 1.2%이었고, 이상반응으로 인한 용량 감량의 빈도는 3.3%이었다.
제이퍼카는 반응률 결과를 바탕으로, 지난 해 1월 미국 FDA 신속승인 절차에 따라 승인을 받았다. 국내에서는 지난 해 6월, 이전에 BTK 억제제로 치료받은 경험이 있는 재발성 또는 불응성 성인 MCL 환자를 대상으로 한 단독요법으로 희귀의약품에 지정되기도 했다.
한국릴리 항암제 사업부 권미라 전무는 “기존 치료 이후, 상태 개선이 없어도 대안이 부재해 적절한 치료를 이어 나가지 못한 MCL 환자에서 이번 제이퍼카의 출시는 치료 가능성을 확장하는 이정표가 될 것으로 생각한다.”라며, “한국릴리는 환자들에게 더 나은 치료 경험을 제공하고 혈액암 치료에 새로운 기준을 제시하기 위해 끊임 없이 노력하겠다.”라고 밝혔다.
한편, 제이퍼카는 현재 약제급여평가위원회 심의와 건강보험공단과의 약가협상, 건강보험정책심의원회 의결 절차를 남겨두고 있다.
[메디컬월드뉴스 김영신 기자]
- TAG



 [피부과 시술 제대로 알기]피부 문제, 튠페이스부터 골드PTT까지 개인별 맞춤 솔루션 필요
[피부과 시술 제대로 알기]피부 문제, 튠페이스부터 골드PTT까지 개인별 맞춤 솔루션 필요
 [피부과 시술 제대로 알기]튼살, 치료 시기에 따른 맞춤형 전략 필요
[피부과 시술 제대로 알기]튼살, 치료 시기에 따른 맞춤형 전략 필요
 [피부과 시술 제대로 알기]봄철 피부 관리, 리프팅부터 색소질환까지 맞춤형 접근 필요
[피부과 시술 제대로 알기]봄철 피부 관리, 리프팅부터 색소질환까지 맞춤형 접근 필요
 [성형외과 시술 제대로 알기] 부작용과 모양 불만족으로 인한 ‘가슴재수술’, 고려할 사항은?
[성형외과 시술 제대로 알기] 부작용과 모양 불만족으로 인한 ‘가슴재수술’, 고려할 사항은?






