식약처 ‘창상피복재 허가·인증·심사 통합 가이드라인’ 발간·배포…주요내용은?
임상자료 심사 대상 판단기준 등 심사에 필요한 자료 명확화
2023-07-08
임재관 newsmedical@daum.net
임재관 newsmedical@daum.net
식품의약품안전처(처장 오유경)가 기존 가이드라인 8종을 통합·현행화한 ‘창상피복재 허가·인증·심사 통합 가이드라인’을 발간·배포한다.
이번 가이드라인의 주요 내용은 ▲창상피복재 분류와 정의 ▲등급별 기술문서 심사·허가·인증 절차 ▲품목별 기술문서 작성 방법 예시 ▲심사에 필요한 자료 요건 ▲임상자료 심사 대상 판단기준 ▲자주하는 질의·답변 등이다.
특히 이번 가이드라인에서는 ▲사용목적, ▲원재료, ▲사용방법 등에 따라 임상시험에 관한 자료 제출이 필요한 경우에 대하여 상세하게 예시를 들어 설명했다.
식약처 의료기기심사부는 “이번 가이드라인이 업체의 창상피복재 제품개발과 신속한 인허가에 도움을 줄 것으로 기대한다”며, “앞으로도 과학적 지식과 규제과학 전문성을 기반으로 안전하고 효과 있는 의료기기가 제품화될 수 있도록 최선을 다해 지원하겠다”고 밝혔다.
한편 기존 가이드라인 8종, 창상피복재 15개 품목은 (메디컬월드뉴스 자료실)을 참고하면 된다.
창상피복재는 상처 부위의 오염방지·피부보호, 삼출액의 흡수, 출혈 또는 체액손실 방지를 목적으로 만들어진 의료기기. 15개 품목(붙임2)을 분류하여 고시하고 있다.
보다 자세한 내용은 식약처 대표 누리집→법령/자료→법령정보→민원인안내서에서 확인할 수 있다.
[메디컬월드뉴스]
- TAG



 [피부과 시술 제대로 알기]겨울철 ‘레이저 리프팅, 색소∙여드름’ 등 피부 관리법은?
[피부과 시술 제대로 알기]겨울철 ‘레이저 리프팅, 색소∙여드름’ 등 피부 관리법은?
 [성형외과 시술 제대로 알기]관심 높아진 레이저 토닝…특징과 주의점은?
[성형외과 시술 제대로 알기]관심 높아진 레이저 토닝…특징과 주의점은?
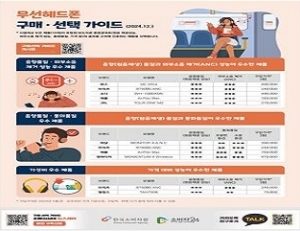 ‘무선헤드폰’ 음향(원음재생 성능)·소음 제거·통화 품질 등에 차이…가격도 최대 19.9배 차이
‘무선헤드폰’ 음향(원음재생 성능)·소음 제거·통화 품질 등에 차이…가격도 최대 19.9배 차이
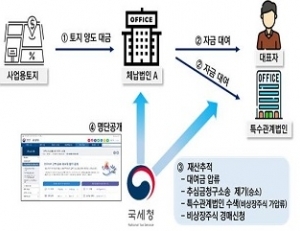 국세청, 2024년 고액・상습체납자 개인 6,033명, 법인 3,633개 명단 공개
국세청, 2024년 고액・상습체납자 개인 6,033명, 법인 3,633개 명단 공개






