7월 25일부터‘보완요구 조정신청제’ 본격 시행
식약처, 허가·심사 민원신뢰도 제고 및 행정절차 투명성 확보
2019-07-25
임재관 newsmedical@daum.net
임재관 newsmedical@daum.net
식품의약품안전처(처장 이의경)가 7월 25일부터 민원인이 보완을 요구받은 사항에 대해 조정을 원하는 경우 공식적으로 의견을 제출할 수 있는 ‘보완요구 조정신청제’를 시행한다고 밝혔다.
‘보완요구 조정신청제’는 민원의 1차 보완요구 사항에 대해 그동안 민원 담당자가 한정된 의견을 내왔던 것을, 앞으로는 ‘혁신제품조정협의회’를 통해 타당성 여부를 검토하여 회신하는 제도이다.
조정 대상은 ▲보완사항이 관련 법령에 근거하고 있지 않다고 판단되는 경우, ▲융복합 혁신의료제품의 이중규제 해결을 요청하는 경우, ▲사전검토 통지서 또는 기술문서 적합통지서 수령 후 허가 신청 시 보완이 필요한 경우 등이다.
보완사항 조정신청 절차는 민원인이 1차 보완 요구받은 후 10일 이내 조정을 신청하면 보완에 필요한 기간은 30일 자동 연장되며, 혁신제품조정협의회 개최 후 조정신청 결과를 통보받게 된다.
(표) 1차 보완사항 조정신청 절차
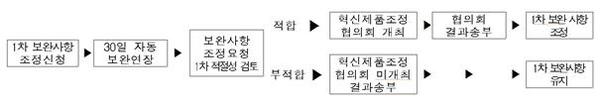
식약처는 “이번 ‘보완사항 조정신청제’를 통해 보완사항에 대한 민원 신뢰도를 높이고 행정절차의 투명성을 확보해 신청인과 허가·심사부처 간의 소통을 확대될 것으로 기대한다”고 밝혔다.
또 “앞으로도 첨단 의료제품의 특성을 반영한 허가·심사제도를 갖추기 위해 개선해 나가겠다”고 덧붙였다.
한편 혁신제품조정협의회는 융복합혁신제품지원단 단장(위원장)과 산·학·연·관 전문가로 구성된다.
(표)혁신제품조정협의회 보완사항 조정절차

[메디컬월드뉴스]



 [피부과 시술 제대로 알기]겨울철 ‘레이저 리프팅, 색소∙여드름’ 등 피부 관리법은?
[피부과 시술 제대로 알기]겨울철 ‘레이저 리프팅, 색소∙여드름’ 등 피부 관리법은?
 [성형외과 시술 제대로 알기]관심 높아진 레이저 토닝…특징과 주의점은?
[성형외과 시술 제대로 알기]관심 높아진 레이저 토닝…특징과 주의점은?
 ‘무선헤드폰’ 음향(원음재생 성능)·소음 제거·통화 품질 등에 차이…가격도 최대 19.9배 차이
‘무선헤드폰’ 음향(원음재생 성능)·소음 제거·통화 품질 등에 차이…가격도 최대 19.9배 차이
 국세청, 2024년 고액・상습체납자 개인 6,033명, 법인 3,633개 명단 공개
국세청, 2024년 고액・상습체납자 개인 6,033명, 법인 3,633개 명단 공개






