임재관 newsmedical@daum.net
식품의약품안전처(처장 류영진)가 ‘다 함께 잘 사는 나라, 안전한 대한민국, 식약처가 함께 하겠습니다’를 주제로 2019년 주요 업무계획을 수립, 발표했다.
식약처는 올해도 의약품·의료기기의 ‘혁신적 포용국가’ 비전을 실현하기 위해 노력한다는 방침이다. 구체적인 추진과제는 다음과 같다.
◆원료의약품 안전관리 강화…품질관리 적정성 등 집중 점검
의약품 제조공정 중 불순물이 생성되어 문제가 된 고혈압약(발사르탄) 사건의 재발 방지를 위해 허가‧등록 시 제조업체로 하여금 불순물 등 유해물질에 대한 안전성 자료를 제출토록 의무화(3월) 하는 등 원료의약품 관리를 강화한다.
해외에서 원료의약품을 수입해 오는 경우에도 해외 제조업소를 사전에 등록하도록 의무화(12월)하고, 위험성이 높은 제조업소를 우선순위로 하여 현지실사를 확대한다.
2∼3월 중 특별점검단을 구성해 국내 원료의약품 제조소와 수입업체에 대해 품질관리 적정성 등을 집중 점검한다는 계획이다.
대한민국 약전 전면 개정(9월)에 따라 안전기준을 국제기준에 맞게 대폭 신설·강화하고, 의약품 품질고도화시스템(QbD : Quality by Design)을 제조품질관리기준(GMP)에 반영(9월)한다.
대한민국 약전은 의약품의 성질상태, 품질 및 저장방법 등과 그밖에 필요한 기준에 대한 사항을 정한 공정서로, 의약품 제조관리 시 반드시 지켜야 하는 사항이다.
◆제네릭, 의료기기 안전성·유효성 검증 강화
유통 의약품의 안전과 품질관리를 강화하기 위해 제네릭 허가제도를 개선하고, 국제수준에 부합하는 심사자료 제출 의무화를 추진(2월∼)한다.
인체 이식형 의료기기는 이미 출시된 의료기기와의 동등성 인정여부와 관계없이 반드시 임상시험을 통해 안전성과 유효성을 검증하도록 의무화(8월)한다.
또 의약품 허가갱신 시 보험청구 실적까지 반영하여 실제 사용되지 않은 제품은 시장퇴출 추진(1월∼), 의료기기도 주기적으로 안전성‧유효성을 재검토하는 품목 허가갱신 제도도 도입(11월)한다.
◆사용자 중심의 안전관리 내실화
의약품 부작용 피해에 대한 국가 보상범위를 비급여 진료비까지 확대하고, 임상시험에 대해서도 표준 피해보상 절차를 마련(6월)한다.
또 환자 신고, 병원 의무기록 등 실제 의료현장의 부작용 정보에 대한 통합 분석체계 마련(10월), 안전사용 정보(DUR)를 반영하지 않은 처방의 부작용 모니터링(1월~) 등 능동적 정보수집 및 공개도 추진한다.
한약재 벤조피렌 등 유해물질을 조사(1∼6월)하고, 주사제 등 액체 형태 의약품의 용기·포장에서 나오는 유해물질 관리방안도 마련(9월)한다.
마약류 통합관리 시스템의 빅데이터 분석을 통해 오남용이 의심되는 마약류 유통·취급자 선별 및 감시한다.
이와 함께 각 의사에게 마약류 처방내역 비교·분석결과 제공(3월), 환자가 본인의 마약류 투약내역을 확인할 수 있는 시스템도 개발(9월∼)한다.
◆희귀·난치질환자 건강 지킴이 사업 본격 추진
희귀·난치질환자가 필요로 하는 해외 대마성분 의약품에 대해 한국희귀·필수의약품센터를 통한 수입을 허용(3월∼)하고, 어린이용 인공혈관 등 희소‧긴급도입 필요 의료기기는 국가가 우선 비용을 지원하여 신속 공급(6월∼)하는 제도를 도입한다.
또 국내 임상시험 의약품뿐 아니라 해외 임상 의약품도 환자치료 목적 사용을 허용(5월)하고, 사용승인 기간도 대폭 단축(7일→즉시)한다.
희귀·난치질환자에게 각종 임상시험 정보(임상시험 종류 및 일정, 참여병원 등)를 투명하게 공개해 임상시험 약에 대한 접근성도 보장한다.
이와 함께 치매치료제‧진단기기 제품화 기술지원단 운영, 희귀‧난치질환용 의약품 신속심사제도도 도입(9월)한다.

◆백신, 필수의약품 안정적 공급
‘국가백신 제품화 기술지원센터’ 구축사업을 통해 백신의 국산화를 지원하고, 인플루엔자·결핵 등 주요 백신의 수급현황을 수시로 모니터링하여 부족한 백신은 신속하게 허가 및 공급하도록 했다.
국가 필수의약품 지정 확대[(2018) 315 → (2019) 400개], 의약품 공급중단을 예측할 수 있는 빅데이터 기반 범정부 통합관리시스템을 구축(3월∼)한다.
◆첨단제품에 대한 새로운 허가·관리체계 구축
첨단 바이오의약품에 대한 맞춤형 심사제도 및 품질관리 기준을 마련(9월)하고, 혁신 의료기기 등에 대한 단계별 심사 등 새로운 허가·관리체계를 구축한다.
◆미래를 대비하는 국제협력
연내 스위스와 의약품 제조품질관리기준(GMP) 상호신뢰협정을 체결하고, EU 화이트리스트에 우리 원료의약품을 등재하여 원활한 의약품 수출을 지원한다.
이를 위해 미국 식약청(FDA), 유럽 의약품청(EMA) 등 선진 규제기관과 비밀유지협약을 체결해 신속한 정보공유를 추진(9월)한다.
한편 2019년 식약처 업무계획은 (바로가기)를 참고하면 된다.
[메디컬월드뉴스]



 [치과에 대한 모든 것]일반적 치아교정과 앞니 미니교정의 차이점과 특징은?
[치과에 대한 모든 것]일반적 치아교정과 앞니 미니교정의 차이점과 특징은?
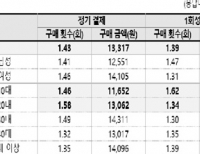 앱 개발자 "인앱결제 가장 큰 문제는 과도한 수수료"
앱 개발자 "인앱결제 가장 큰 문제는 과도한 수수료"
 [성형외과 시술 제대로 알기]노화로 인한 얼굴 처짐 개선 ‘안면거상술’ 특징과 주의할 점은?
[성형외과 시술 제대로 알기]노화로 인한 얼굴 처짐 개선 ‘안면거상술’ 특징과 주의할 점은?
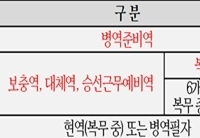 5월 1일부터 병역미필자 모두에게 '10년 복수여권 발급'
5월 1일부터 병역미필자 모두에게 '10년 복수여권 발급'






