김영신 medicalkorea1@daum.net
국내에서 코로나백신 개발을 위한 임상실험 중 예상하지 못한 중대한 약물이상반응이 발생했을 경우 해당 기업은 식약처에 즉각 보고하기로 되어 있다.
하지만 국내 코로나백신 개발 임상시험 중 심근경색 부작용으로 인해 사망자가 발생했음에도 식품의약품안전처가 관련 보고를 받고도 이를 공개하지 않았다는 지적이 제기됐다.
국회 보건복지위원회 강기윤(국민의힘, 창원성산)간사가 식약처로부터 받은 ‘백신 임상시험 중 예상하지 못한 중대한 약물이상반응(susar) 보고 사례’에 따르면 이같이 나타났다.
(표)코로나백신 임상시험 중 예상하지 못한 중대한 약물이상반응(susar) 보고 사례
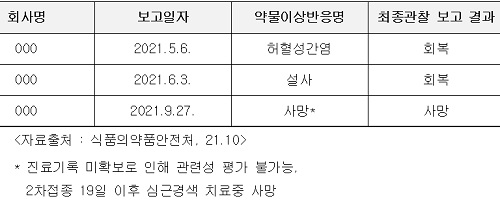
식약처에 보고된 사례에 따르면, A기업에서 실시했던 임상시험 중 지난 9월 심근경색 부작용으로 인해 사망한 환자가 발생했음에도 임상시험을 진행하고 있다는 것이다.
이에 대해 강기윤 의원은 “보건복지부, 질병청 2일차 국정감사에서 코로나백신 접종 부작용과 이상반응으로 인해 고통받고 있는 국민들의 이야기로 국정감사장이 숙연해졌다”며,“국내 코로나백신개발 임상시험 중 심근경색 부작용으로 인해 사망자가 발생했음에도 국민들에게 알리지 않은 것은 국민들의 이러한 고통을 외면하고 있는 것이다”고 밝혔다.
이어 “식약처는 지난 4월에 조직된 ‘코로나백신, 치료제 개발 범정부위원회 6차회의(20.9.25)’에서 이러한 중대한 부작용 등을 과학적으로 평가하여 공개할 계획이라고 밝혔던만큼, 향후 이러한 중대한 부작용이 발생했을 경우 국민들께 소상히 알릴 수 있도록 제도를 개선할 필요가 있다”고 강조했다.
[메디컬월드뉴스 김영신 기자]
- TAG



 [모발이식 제대로 알기]MZ 세대 탈모 환자 증가…나이 고려한 맞춤형 접근 필요
[모발이식 제대로 알기]MZ 세대 탈모 환자 증가…나이 고려한 맞춤형 접근 필요
 [성형외과 시술 제대로 알기]코끝 연골 묶기 후 들창코∙짧은코 되는 원인과 해결 방법은?
[성형외과 시술 제대로 알기]코끝 연골 묶기 후 들창코∙짧은코 되는 원인과 해결 방법은?
 [피부과 시술 제대로 알기]겨울철 ‘레이저 리프팅, 색소∙여드름’ 등 피부 관리법은?
[피부과 시술 제대로 알기]겨울철 ‘레이저 리프팅, 색소∙여드름’ 등 피부 관리법은?
 [성형외과 시술 제대로 알기]관심 높아진 레이저 토닝…특징과 주의점은?
[성형외과 시술 제대로 알기]관심 높아진 레이저 토닝…특징과 주의점은?






