김영신 medicalkorea1@daum.net
5월 1주(4.30~5.6)에 최소잔여형 주사기(LDS 주사기) 이물 보고 3건이 접수됐다.
이에 식품의약품안전처(처장 김강립)는 해당 업체에 대해 원인분석 및 시정·예방조치를 명령했다.
◆이물 발생 3건 주요 내용은?
이번에 보고된 이물 발생 3건의 내용은 다음과 같다.
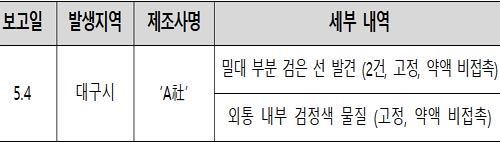

이번에 보고된 3건의 이물은 주사기 밀대, 외통 부분에 고정되어 박혀있는 상태로 인체에 혼입될 가능성이 없음을 확인했고, 해당 주사기는 모두 접종 준비단계에서 발견되어 사용되지 않았다.
또 해당 제조업체는 이물 혼입을 최소화하기 위해 열처리 공정 이후 처리 과정을 개선하고 품질 관리 인력을 증원했다.
◆제품 품질 개선 노력 시작
식약처는 GMP 전문가 등 민·관 전문가 컨소시엄을 5월 6일 구성하고, 국내 최소잔여형 주사기를 공급하고 있는 4개 제조업체에 대한 현장진단을 통해 생산시설의 공정개선 등 제품의 품질을 개선하기 위한 노력을 시작했다는 설명이다.
또 이날 주사기 이물 혼입의 원인분석과 저감화를 위한 개선방향에 대해 국내 주사기 6개 제조업체와 간담회를 개최했으며, 현장의 애로사항을 듣고 앞으로도 원자재 검사, 제조공정 및 출하검사 관리 등을 지속적으로 논의하기로 했다.
특히 이번 간담회에서 주사기에 사용되는 부품들은 플라스틱 사출물로서 열처리 과정에서 원재료 탄화체(흑점) 등이 사출물에 포함되어 이물로 신고 되는 사례에 대해서도 논의했다.
그 결과 해당 제품은 이물이 아닌 외형상의 불량으로 인체유입, 약액 접촉으로 인한 오염 등의 우려는 없지만 보다 철저한 공정검사를 통해 불량품을 걸러낼 수 있는 방안을 정부·산업계 협의체를 구성해 긴밀히 협의하기로 했다.
식약처 의료기기안전국 의료기기관리과는 “주사기 제조업체에 제조공정에서 이물이나 품질 불량이 발생되지 않도록 장비 세척, 제조시설 정비 등 철저히 점검 하도록 당부하고, 지속적으로 품질관리를 위해 기술지원 할 예정이다”고 밝혔다.
[메디컬월드뉴스 김영신 기자]



 보건복지부, 울산시·광주 광산구 등 18개 의료급여 우수 지자체 선정 표창
보건복지부, 울산시·광주 광산구 등 18개 의료급여 우수 지자체 선정 표창






