국립암센터 국제암대학원대학교(총장 이은숙) 이병일, 장현철 교수팀이 여러 발암 유전자를 동시에 제어할 수 있는 새로운 약물 표적을 발굴했다. 교수팀은 관련 원천 특허도 출원했다.
교수팀은 다수의 발암 유전자들을 동시에 제어하는 방법을 찾아 현행 표적 항암제의 한계를 극복하고자 했다.
교수팀은 다수의 발암 유전자들이 특이적으로 이용하는 전령RNA(mRNA)의 이동 경로에 주목했는데, API5(Apoptosis inhibitor 5)와 FGF2(Fibroblast Growth Factor 2)라는 단백질의 복합체가 c-Myc, CCND1과 같은 주요 발암 유전자의 전령RNA 이동을 제어하는 데 중요한 기능을 함을 밝혀냈다.
API5 유전자는 자궁경부암, 폐암, 유방암, 췌장암을 비롯한 다양한 암에서 과발현되어 있는 유전자로, 세포 사멸 억제 임무를 수행한다.
FGF2는 세포 밖으로 분비되는 증식인자이지만 세포핵에도 상당량 존재하며, 이러한 핵형 FGF의 기능은 지난 수십 년간 명확히 알려지지 않았다.
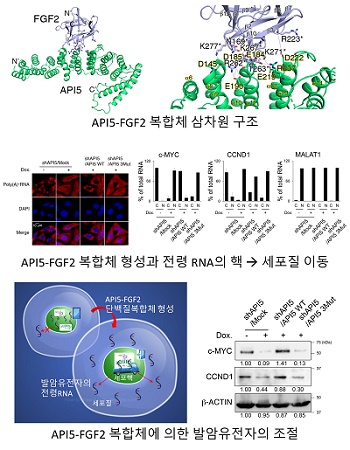
교수팀은 API5와 FGF2의 복합체에 대한 삼차원 구조를 X-선 결정학 방법으로 규명하고, API5-FGF2 복합체에 결합하는 단백질 군을 액체 크로마토그래피-질량분석법을 이용해 동정했다.
얻어진 정보를 생물 정보학 기법으로 분석해 API5-FGF2 복합체가 전령RNA의 세포핵에서 세포질로의 이동에 관여할 것이라는 가설을 세웠고, 실험을 통해 이를 증명했다.
특히 API5와 FGF2의 결합이 억제되는 경우 암세포 내에 c-Myc과 CCND1과 같은 발암 유전자 단백질의 양이 크게 낮아짐을 확인했다. 이는 여러 발암 유전자들을 동시에 조절하는 새로운 항암제 표적이 탄생할 수 있음을 의미한다.
이번 연구는 국립암센터 기관고유사업, 국립암센터 발전기금 및 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
이번 연구 성과는 저명한 국제학술지 Nucleic Acids Research(영향력지수 11.147, 5월 7일 기준, 출처 Oxford University Press)에 발간됐다.

교수팀은 후속연구로 API5-FGF2를 표적으로 하는 신규 항암제 후보물질의 발굴이 진행 중이다.
한편 암의 가장 큰 발생 원인은 여러 발암 유전자(oncogene)들의 과발현이다. 발암 유전자는 암의 발생뿐 아니라 증식 및 전이에도 관여하기 때문에 발암 유전자를 억제해 암을 치료하고자 하는 연구가 곳곳에서 활발히 진행되고 있다.
현재 발암 유전자를 억제하는 표적 항암제들이 임상에 다양하게 이용되고 있지만 많은 경우 내성이 생겨 지속적인 효과를 발휘하지 못하는 단점이 있다.
즉 현재 임상에서 사용 중인 표적 항암제들은 대부분 한두 가지의 발암 유전자를 표적하므로, 해당 표적이 아닌 다른 발암 유전자에 의존해 증식하는 암을 치료할 수 없다.
세포핵(nucleus)의 염색체에 있는 유전정보는 전령RNA(mRNA)로 옮겨지고, 전령RNA는 핵막을 통과하여 세포질(cytosol)에 있는 단백질 합성 공장으로 이동한다. 단백질 합성 공장에서 만들어지는 각각의 유전정보에 상응하는 단백질들이 생명현상과 관련된 수많은 일을 분업하는 일꾼들이다.
[메디컬월드뉴스 김영신 기자]