식품의약품안전처(처장 정승) 식품의약품안전평가원이 의료기기 업체가 허가 신청 시 제출하는 물리‧화학적 특성에 관한 자료 중 용출물 시험을 효율적으로 적용하고, 제출 자료의 범위를 명확화 하기 위해 ‘의료기기의 물리‧화학적 특성에 관한 자료 심사 지침’을 발간한다고 밝혔다.
이번 지침의 주요내용은 ▲용출물 시험자료 제출대상 품목 및 시험항목 ▲제출자료의 종류 판단 흐름도 ▲플라스틱재 용출물 시험의 기준 및 방법 ▲용출물 시험 적용 제외 품목 등이다.
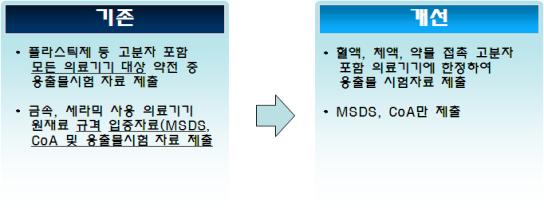
용출물 시험은 인체에 주입되는 혈액‧체액‧약물 등과 접촉하는 고분자를 포함하는 의료기기의 경우에만 한정하여 적용하도록 하였다.
또 금속, 세라믹 재질 등을 원재료 또는 완제품으로 사용하는 의료기기의 경우에는 해당 원재료의 재질 분석자료를 제출하면 용출물 시험자료를 추가로 제출할 필요가 없도록 개선하였다.
식약처는 “이번 지침서를 통해 용출물 시험자료의 제출 여부와 그 범위를 명확히 하는 등 제도를 합리적으로 개선하였으며, 허가심사의 일관성·공정성을 확보하여 민원만족도 향상에 큰 도움이 될 것이다”고 밝혔다.
자세한 내용은 홈페이지(
www.mfds.go.kr → 법령․자료 → 법령정보 → 지침, 가이드라인, 해설서)에서 확인할 수 있다.
(그림)용출물 시험 주요 개선사항 비교
* MSDS (Material Safety Data Sheet) : 물질안전보건자료
* CoA (Certificate of Analysis) : 원재료시험성적서