식품의약품안전처(처장 오유경)가 ‘첨단바이오의약품 장기추적조사 관리기준’(식약처 고시)을 8월 21일 개정했다고 밝혔다.
주요 개정 내용은 ▲장기추적조사계획에 포함해야 하는 세부 사항 구체화, ▲장기추적조사 대상 지정 해제 요건 및 절차 등 마련, ▲상위법령 개정에 따라 장기추적조사계획 및 결과 등의 접수‧검토 업무를 첨단바이오의약품 규제과학센터로 일원화하는 것이다.
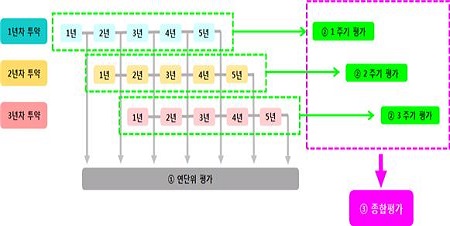
(그래프)장기추적조사 종합평가 예시(모집기간 3년, 장기추적조사 지정기간이 5년인 경우)
식약처 바이오생약국은 “이번 고시 개정이 첨단바이오의약품 업계에 도움을 줄 것으로 기대한다.”라며, “앞으로도 첨단바이오의약품을 투여받은 환자의 안전을 꼼꼼하게 관리하기 위해 첨단바이오의약품 장기추적조사 제도를 철저하게 운영할 계획이다.”라고 밝혔다.
한편 ▲장기추적조사계획 세부사항 구체화, ▲장기추적조사 대상 지정 해제 등은 (메디컬월드뉴스 자료실)을 참고하면 된다.
이번에 개정된 고시의 자세한 내용은 ‘국가법령정보센터→ 행정규칙’ 또는 ‘식품의약품안전처 대표 누리집 → 법령/자료 → 법령정보 → 제개정고시등’에서 확인할 수 있다.
[메디컬월드뉴스]