간암은 폐암에 이어 국내 암 사망 원인 2위이며, 현재 간암으로 인한 연간 경제적 부담은 암 중 1위를 차지하고 있다.
따라서 간암 환자 치료에 직접적인 도움을 줄 수 있는 조직학적 바이오마커 발굴이 절실하다.
서울대학교 정도원(제1저자), 박종완·조주연·이광웅 교수, 서지은(현 요코하마국립대학교) 김경석·김지영·김예리·박사(공저자), 고려대학교 허준(공저자) 교수, ,준지 후쿠다 교수 (요코하마국립대학교/공저자), 서울대학교 전양숙(교신저자) 교수 연구팀은 팔미트산이 간암 세포에서 PHF2를 파괴하여 지방 합성을 촉진하며, 그 분자 기전으로 PHF2가 팔미트산에 의해 팔미토일화된 후 유비퀴틴화에 의해 파괴됨을 밝혔다..
PHF2가 간암 세포에서 지방 합성을 지휘하는 주요 전사인자인 SREBP1c의 유비퀴틴화 효소임을 밝혔다.
또한 PHF2를 매개한 SREBP1c의 파괴는 지방산 합성과 암 증식을 모두 억제했으며, 이는 PHF2의 새로운 기능을 제시한 최초의 연구 결과이다. .
팔미트산 혹은 PHF2 발현 저하로 인해 SREBP1c 단백질이 증가하면, 이는 팔미트산을 포함한 지방산을 재생산시킴. 팔미트산의 양적 증가는 최종적으로 [팔미트산 ⇒ PHF2 파괴 ⇒ SREBP1c 증가 ⇒ 팔미트산 증가] 악순환 회로를 유도하여 간암을 악성화시킨다.
이러한 연구 결과는 간암 환자에게 지방 섭취 제한이 중요함을 시사한다. .
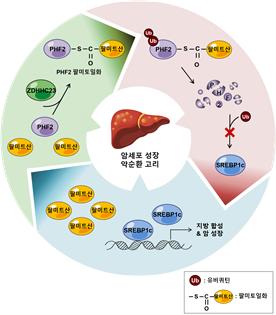
[그림] 본 연구에서 규명된 팔미트산-PHF2-SREBP1c 악순환 고리 모식도
(팔미트산이 적은 환경에서는 안정화된 PHF2가 SREBP1c를 분해하여 지방 합성과 암세포 성장이 저하됨. 하지만 팔미트산이 풍부한 환경에서는 팔미트산이 PHF2를 팔미토일화하여 PHF2 단백질을 분해함. 이에 따라 안정화된 SREBP1c가 팔미트산을 포함한 지방의 합성을 다시 증가시킴. 결과적으로 증가한 팔미트산이 암세포 증식을 촉진하는 악순환 고리를 초래함.)
간암 환자의 간에서는 포화지방산이 증가하여 암이 악성화된다. 그러나 과량의 지방산에 의한 암 증식 기전이 제대로 밝혀지지 않아, 근본적인 치료가 어려운 상황이다. .
이번 연구는 지방산 중 팔미트산이 간암 세포 내 지방 대사를 변화시켜 간암을 악성화시키는 것을 밝혔다.
그 분자 기전은 팔미트산이 암 억제 단백질인 PHF2를 팔미토일화시켜 단백질 파괴를 유도함을 밝혔다.
이번 연구 결과는 팔미트산이 간암 악성화를 초래하는 고리의 원인이 될 수 있음을 밝혀, 향후 간암 환자의 지방식이 제한이 간암 치료의 효과적인 돌파구가 될 수 있음을 시사한다.
이번 연구 성과는 세포생물학 분야 저명 국제학술지인 Nature Communications (2022 영향력 지수: 16.6)에 2023년 10월 12일에 ‘A research team led by Professor Yang-Sook Chun from the Department of Physiology & Biomedical Sciences at SNU has uncovered the molecular mechanism of palmitoylation-driven lipid reprogramming in liver cancer cells. This research was published in Nature Communications (Impact factor:16.6) in October 2023’.라는 내용으로 게재됐다.
[메디컬월드뉴스 김영신 기자]