식품의약품안전처(처장 오유경)가 국산 코로나19 백신 개발을 지원하기 위해 ‘코로나19 백신 개발 시 고려사항’ 안내서(’20.6 제정)를 개정·배포한다.
주요 개정 내용은 다음과 같다.
▲임상시험용 mRNA 백신 생산 시 연구용 세포주 사용 허용
코로나19 mRNA 백신 개발 시 안전성이 입증된 연구용 세포주를 이용하여 임상시험용 백신을 생산할 수 있도록 허용(식·의약 규제혁신 100대 과제 중 2번 과제)함을 명시하여 국내 개발 코로나19 백신의 신속한 임상 진입을 지원했다.
▲변이주 백신에 대한 품질·비임상 자료 간소화
코로나19 바이러스 변이주 백신 개발 시 모체백신과 동등하게 변이주 백신을 생산하는 경우 모체백신 개발 시 확보한 일부 품질·비임상 자료를 활용할 수 있도록 제출자료를 간소화하여 국산 코로나19 백신의 신속한 개발을 지원했다.
▲다가 백신 개발 시 품질·임상·비임상 분야별 고려사항
변이주를 포함한 추가 접종용 다가 백신 개발 시 품질, 비임상 자료 요건을 상세하게 설명했다.
▲소아 대상 임상시험 설계 시 고려해야 할 사항
코로나19 감염이력, 대조백신 선정 등 소아 대상 임상시험 설계 시 고려해야 할 사항도 안내했다.
식약처 평가원 바이오생약심사부는 “이번 안내서 개정이 코로나19 백신 등 국내에서 백신을 개발할 때 도움을 줄 것으로 기대한다”며, “앞으로도 전문성과 규제과학을 기반으로 1:1 맞춤형 기술지원 등 국산 백신의 연구개발부터 허가까지 모든 과정을 계속해서 밀착 지원하겠다”고 밝혔다.
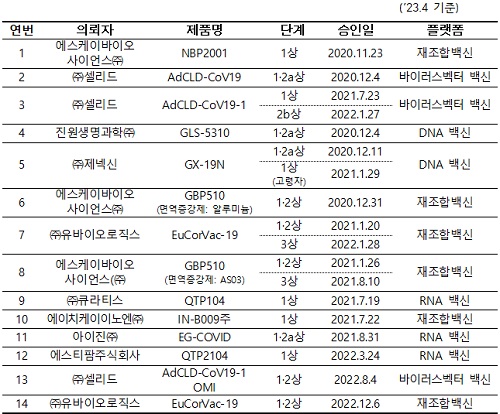
한편 ㈜셀리드, 진원생명과학㈜, ㈜제넥신, ㈜유바이오로직스, 에스케이바이오사이언스(㈜, ㈜큐라티스, 에이치케이이노엔㈜, 아이진㈜, 에스티팜주식회사 등의 임상승인 현황은 다음과 같다.
(표)국내 개발 코로나19 백신 임상승인 현황
이번에 개정된 안내서는 식약처 대표 누리집→법령/자료→법령정보→민원인안내서에서 확인할 수 있다.
[메디컬월드뉴스]