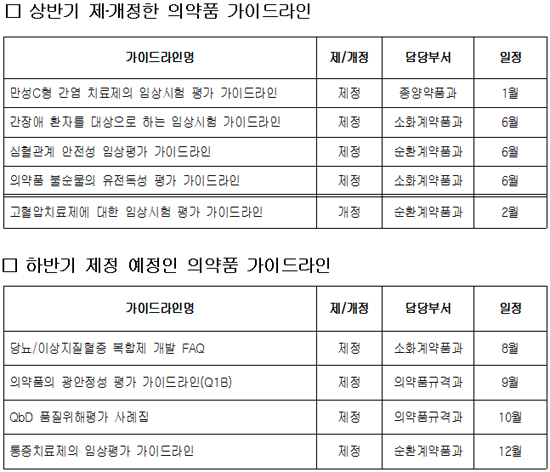
식품의약품안전처(처장 김승희) 식품의약품안전평가원이 의약품 개발을 지원하고 개발자 등의 이해를 돕기 위해 심사 시 고려사항에 대한 가이드라인 3종을 마련했다고 밝혔다.
이번 가이드라인은 ‘간장애 환자를 대상으로 하는 임상시험 가이드라인’, ‘심혈관계 안전성 임상평가 가이드라인’, ‘의약품 불순물의 유전독성 평가 가이드라인’으로 관련 학회, 외부전문가 및 제약사 개발담당자 등의 자문을 거쳐 마련하였다.
‘간장애 환자를 대상으로 하는 임상시험 가이드라인’의 주요 내용은 ▲간장애 환자 대상 임상시험 수행 기준 ▲시험방법 및 자료 분석 안내 등이다.
‘심혈관계 안전성 임상평가 가이드라인’의 주요 내용은 ▲부정맥 유발 가능성에 대한 평가방법 ▲심전도 자료의 분석방법 등이다.
‘의약품 불순물의 유전독성 평가 가이드라인’의 주요 내용은 ▲유전독성 평가를 위한 컴퓨터 분석방법(시뮬레이션) 안내 ▲안전성 확보를 위한 허용기준 설정방법 등이다.
안전평가원은 올해 상반기 동안 6월에 새로 마련한 가이드라인 3종을 포함해 총 4종의 가이드라인을 제정했다.
또 지난 2월에는 ‘고혈압치료제에 대한 임상시험 평가 가이드라인’을 최신 기술을 반영하여 개정한바 있다.
안전평가원은 “이번에 새로 마련한 가이드라인 3종을 통해 의약품 개발을 위해 수행하는 시험에 대한 이해를 돕는데 도움이 될 것이다”고 밝혔다.
아울러 올해 안에 ‘통증치료제의 임상평가 가이드라인’ 등 4종의 가이드라인을 추가로 제정할 예정이다.
(표)올해 제·개정 가이드라인 목록