질병관리청(청장 정은경) 국립보건연구원(원장 권준욱)이 지난 9일 ‘첨단재생의료 안전관리에 관한 규정’을 제정했다고 밝혔다.
이번에 제정된 고시의 주요 내용은 다음과 같다.
▲재생의료기관은 임상연구 계획서 적합 통보 또는 승인을 받은 날로부터 30일 이내에 과제 기본정보를 국립보건연구원에서 운영하는 임상연구정보시스템에 등록해야 하며, 임상연구 진행에 따라 추가적 기록이 발생하면 7일 이내에 등록해야 한다.
▲재생의료기관은 연구대상자에게 이상반응이 발생한 경우 그 중증도에 따라 지체 없이 또는 30일 이내에 국립보건연구원으로 보고하도록 규정했다.
국립보건연구원은 진행 중인 임상연구에 대한 모니터링을 정기적으로 수행해야 하며, 이상반응 발생 원인에 대한 조사와 장기추적조사 계획을 수립하여 시행하도록 규정했다.
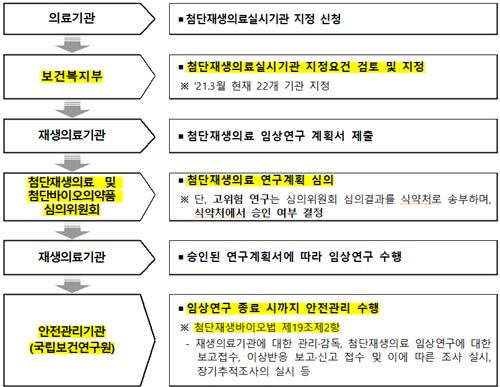
(표)첨단재생의료 임상연구 수행절차
국립보건연구원 권준욱 원장은 “이번 고시 제정을 통해 안전관리기관 업무 세부사항을 명확히 함으로써 재생의료기관 연구수행의 예측성을 높이고 연구대상자의 안전성 확보에 기여할 수 있을 것으로 기대한다”고 밝혔다.
한편 ‘첨단재생바이오법’에 따라 줄기세포치료, 유전자치료 등을 실시하려는 의료기관은 보건복지부로부터 첨단재생의료실시기관(이하‘재생의료기관) 지정 및 임상연구 계획서 심의를 받아야 하며, 연구진행사항은 첨단재생의료안전관리기관에 보고해야 한다.
국립보건연구원은 ‘첨단재생바이오법 시행규칙’에 따라 첨단재생의료 안전관리기관으로 지정됐으며, 이번 고시 제정을 통해 재생의료기관과 국립보건연구원 간에 효율적 업무가 가능하도록 안전관리업무의 세부사항을 마련했다.
[메디컬월드뉴스]